Wärmelehre
1. Wärmelehre – Thermodynamik
1.1 Temperatur, Ausdehnung
Temperatur ist ein Maß für den Wärmezustand eines Körpers.
Ausdehnung fester Körper durch Temperaturänderung
Brücken sind auf Rollen gelagert und haben Lücken, um die Längenausdehnung zu ermöglichen. Radreifen werden erwärmt, auf die Wagenräder gesteckt und durch Abkühlung befestigt. Für die Längenausdehnung gilt: ![]()
|
Körper |
Ausdehnungskoeffizient a |
Körper |
Ausdehnungskoeffizient a |
|
Hartgummi |
75-100 · 10-6 1/K |
Eisen |
12 · 10-6 1/K |
|
Natrium |
71 · 10-6 1/K |
Beton |
12 · 10-6 1/K |
|
Aluminium |
23,8 · 10-6 1/K |
Glas |
9 · 10-6 1/K |
|
Messing |
18,5 · 10-6 1/K |
Cerodur (Glaskeramik) |
< 0,1 · 10-6 1/K |
Mit Bimetallen lassen sich Thermometer und Thermoschalter bzw. Thermostate herstellen.

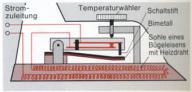 ,
,
Ausdehnung flüssiger Körper durch Temperaturänderung
Das Thermometer nutzt die Ausdehnung von Flüssigkeiten. Es gilt: ![]()
|
Körper |
Ausdehnungskoeffizient g |
Körper |
Ausdehnungskoeffizient g |
|
Benzol |
10,6 · 10-4 1/K |
Quecksilber |
1,8 · 10-4 1/K |
|
Alkohol |
11 · 10-4 1/K |
Wasser |
2,07 · 10-4 1/K |
|
Glyzerin |
5 · 10-4 1/K |
Wasser < 4°C |
-0,7 · 10-4 1/K |
Anders Celsius skalierte das erste Quecksilber-Thermometer mit 0°C für den Schmelzpunkt und mit 100°C für den Siedepunkt von Wasser bei Normaldruck (1013hPa). Da sich Quecksilber konstant ausdehnt, eignet es sich besonders gut.
Anomalie des Wassers
Wasser hat bei 4°C seine größte Dichte. Daher mischen sich bei weiterer Abkühlung die Schichten nicht mehr durch und ein See gefriert nur langsam von der Oberfläche nach unten. Tiere und Pflanzen können so am Grund überleben.
Ausdehnung von Gasen durch Temperaturänderung
Vakuumverschlüsse von Lebensmitteln nutzen die Volumenän-derung von Luft. Bei konstantem Druck gilt nur für Gase:
![]() . Somit hätte jedes Gas kein Volumen, wenn die Temperatur den absoluten Temperaturnullpunkt bei ca. –273,15°C erreicht. Deshalb ist in der Physik die Kelvin-Skalierung gebräuchlich mit
. Somit hätte jedes Gas kein Volumen, wenn die Temperatur den absoluten Temperaturnullpunkt bei ca. –273,15°C erreicht. Deshalb ist in der Physik die Kelvin-Skalierung gebräuchlich mit ![]() .
.
1.2 Zustandsgleichung
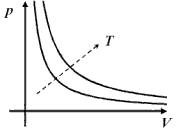 |
Festkörper und Flüssigkeiten sind nahezu inkompressibel. Für Gase findet man experimentell:
|
Ebenso gilt:
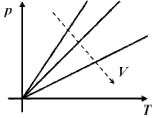 |
|
Für ein ideales Gas – die Moleküle haben keine Ausdehnung – lassen sich diese beiden Gesetze zusammenfassen:
![]() bzw.
bzw. ![]() , mit p Druck, V Volumen, T Temperatur, N Teilchenanzahl,
, mit p Druck, V Volumen, T Temperatur, N Teilchenanzahl, ![]()
1.3 Brown’sche Bewegung
Temperatur ist proportional zur mittleren Bewegungsenergie eines völlig ungeordnet bewegten Gasatoms. (Brockhaus)
Die Kurve einzelner Teilchen A unter dem Einfluss der Stöße mit Molekülen B lässt sich unter dem Mikroskop verfolgen. Man beobachtet eine statistisch verteilte Bewegung aus kurzen geraden Stücken zwischen zwei Stößen. ![]() .
.
Diese statistische Bewegung – genannt Brown’sche Bewegung – mikroskopisch kleiner Teilchen gibt einen indirekten Hinweis auf die Bewegung der stoßenden Moleküle und damit einen Einblick in die Molekularstruktur der Materie.
Die Temperatur ist ein Maß für die mittlere kinetische Energie der Teilchen ![]() , der Druck ist ein Maß für die Wechselwirkung der einzelnen Teilchen. Die Wärmearbeit ist somit Energieübertragung von Teilchen auf andere und damit der Ausgleich der mittleren kinetischen Energie.
, der Druck ist ein Maß für die Wechselwirkung der einzelnen Teilchen. Die Wärmearbeit ist somit Energieübertragung von Teilchen auf andere und damit der Ausgleich der mittleren kinetischen Energie.
Der absolute Temperaturnullpunkt ist also erreicht, wenn die kinetische Energie aller Gas-Teilchen null ist.
1.4 Reibungsarbeit
Verrichtet man Reibungsarbeit an einem Körper, so steigt seine Temperatur an. Versuche zeigen: ![]()
|
Feste Körper |
spezifische Wärmekapazität cV |
Flüssigkeiten |
spezifische Wärmekapazität cV |
|
Aluminium |
0,895 J/gK |
Wasser |
4,19 J/gK |
|
Kupfer |
0,389 J/gK |
Alkohol |
2,43 J/gK |
|
Eis |
2,10 J/gK |
Quecksilber |
0,14 J/gK |
|
Wasserstoff |
10,2 J/gK |
Luft |
0,716 J/gK |
1.5 Innere Energie, Energieerhaltung
Die innere Energie U eines Gases ist die gesamte Energie seiner N Moleküle. Die Freiheitsgrade f der Moleküle berücksichtigen Translation, Rotation und Schwingung der Moleküle. Damit gilt: ![]() ideales Gas:
ideales Gas: ![]()
1. Hauptsatz: ![]() : Die Summe der einem System von außen zugeführten Wärme DQ und der zugeführten Arbeit DW ist gleich der Zunahme seiner inneren Energie DU.
: Die Summe der einem System von außen zugeführten Wärme DQ und der zugeführten Arbeit DW ist gleich der Zunahme seiner inneren Energie DU.
• Isochorer Prozess ![]() : Die zugeführte Wärme wird vollständig zur Erhöhung der inneren Energie verwendet.
: Die zugeführte Wärme wird vollständig zur Erhöhung der inneren Energie verwendet. ![]() → Reibungsarbeit
→ Reibungsarbeit
• Isobarer Prozess ![]() : Die zugeführte Wärmemenge wird vollständig zur Erhöhung der Enthalpie verwendet.
: Die zugeführte Wärmemenge wird vollständig zur Erhöhung der Enthalpie verwendet. ![]() (
(![]() )
)
→ Chemie
• Isothermer Prozess ![]() : Die zugeführte Wärme wird vollständig in Arbeit umgewandelt.
: Die zugeführte Wärme wird vollständig in Arbeit umgewandelt. ![]() → Boyle-Mariotte
→ Boyle-Mariotte
• Adiabatischer Prozess ![]() : Das System tauscht keine Wärme mit seiner Umgebung aus – Volumen- oder Druckänderungen verlaufen sehr schnell.
: Das System tauscht keine Wärme mit seiner Umgebung aus – Volumen- oder Druckänderungen verlaufen sehr schnell. ![]()
![]() ,
, ![]() mit
mit ![]() → Carnot
→ Carnot
2. Hauptsatz: Wärme fließt von selbst immer nur vom wärmeren zum kälteren Körper, nie umgekehrt.
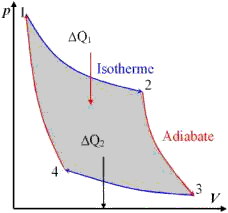 |
Carnot’scher Kreisprozess:1→2: isotherm
2→3: adiabatisch Þ 3→4: isotherm
4→1: adiabatisch
Wirkungsgrad: |
3. Hauptsatz: Es ist prinzipiell unmöglich, den absoluten Temperaturnullpunkt zu erreichen.
1.6 Wärmeübertragung
Die relative Wärmeleitfähigkeit gibt an, wie gut Wärme innerhalb eines Stoffes ausgebreitet bzw. isoliert wird.
|
CO2 |
0,58 |
Holz |
5 |
|
Luft |
1,0 (per def.) |
Wasser |
23 |
|
Seide / Wolle |
1,5 |
Stahl (Fe) |
1’800 |
|
Baumwolle |
2,5 |
Aluminium |
8’500 |
|
Plexiglas |
7 |
Kupfer |
15’100 |
Konvektion nennt man die durch Wärmedifferenz bedingte Strömung von Teilchen in Flüssigkeiten und Gasen. Man unterscheidet laminare, z.B. Winde, Heizströmung, und turbulente Strömungen, z.B. Bénard-Strömung.
Die Wärmestrahlung durch transversale elektromagnetische Wellen, z.B. Infrarot-Strahlen, breitet sich auch im Vakuum aus. Für die abgestrahlte Wärmemenge gilt: ![]() mit S Oberfläche,
mit S Oberfläche, ![]() → Wand-, Fensterdämm.
→ Wand-, Fensterdämm.
1.7 Wärmeleistung
chemische Energie
|
Brennstoff |
Heizwert |
Brennstoff |
Heizwert |
|
|
Holz |
18,8 MJ/kg |
Wasserstoff |
10,8 MJ/m³ |
|
|
Koks |
29,3 MJ/kg |
= 120 MJ/kg |
||
|
Steinkohle |
31,8 MJ/kg |
Erdgas |
33,5 MJ/m³ |
|
|
Heizöl, Benzin |
43 MJ/kg = 30,1 GJ/m³ |
» 12,4 MJ/kg |
||
(NuT 104)
1.8 Aggregatzustand
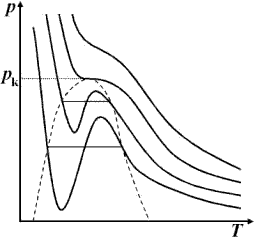 |
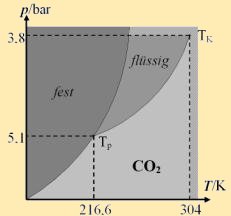
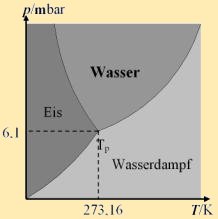
Berücksichtigt man bei realen Gasen das Eigen-volumen b und den resultierenden Binnendruck a/ V ², so ergibt sich als Zustandsgleichung: Entlang der Van-der-Waals-Isothermen findet ein Phasenübergang statt. f↔fl :Schmelzen/Gefrieren Beim Phasenübergang wird Wärmeenergie umgesetzt, trotz konstanter Temperatur. Man bezeichnet den Zustand des Phasenübergangs auch als Koexistenz. Die Koexistenz aller Zustände heißt Tripelpunkt T p, das Ende der fl–g-Koexistenzlinie heißt kritischer Punkt T K. |
|
Stoff |
TK |
pK |
Tf ↔ fl |
Tfl ↔ g |
QS |
QD |
|
Blei |
5400 K |
600 K |
1022 K |
25 J/g |
858 J/g |
|
|
Eisen |
5966 K |
1808 K |
3134 K |
268 J/g |
6260 J/g |
|
|
Wasser |
647 K |
221 bar |
273 K |
373 K |
334 J/g |
2257 J/g |
|
CO2 |
304 K |
73 bar |
194 K |
180 J/g |
||
|
Sauerstoff |
155 K |
51 bar |
54 K |
90 K |
13 J/g |
213 J/g |
1.9 technische Nutzung
Dampfmaschine, Stirling-Maschine (PH 317)
Kühlschrank, Wärmepumpe (NuT 119, PH 316)
4-Takt-Ottomotor (PH 318)
Oktan ![]()
Turbine (NuT 127)
→ reversible – irreversible Prozesse
Du möchtest mehr?
Nachhilfe
Du schreibst bald einen Test, verstehst ein bestimmtes Thema aber noch nicht oder du brauchst einfach nur Hilfe bei den Hausaufgaben?
Du kannst mich gerne jederzeit kontaktieren, damit wir einen Termin ausmachen können.
Coaching
Prozent- und Zinsrechnungen sind nicht so dein Ding?
Ich kann dir dabei helfen, altes Wissen wieder aufzufrischen.
Du kannst mich gerne jederzeit kontaktieren, damit wir einen Termin ausmachen können.
